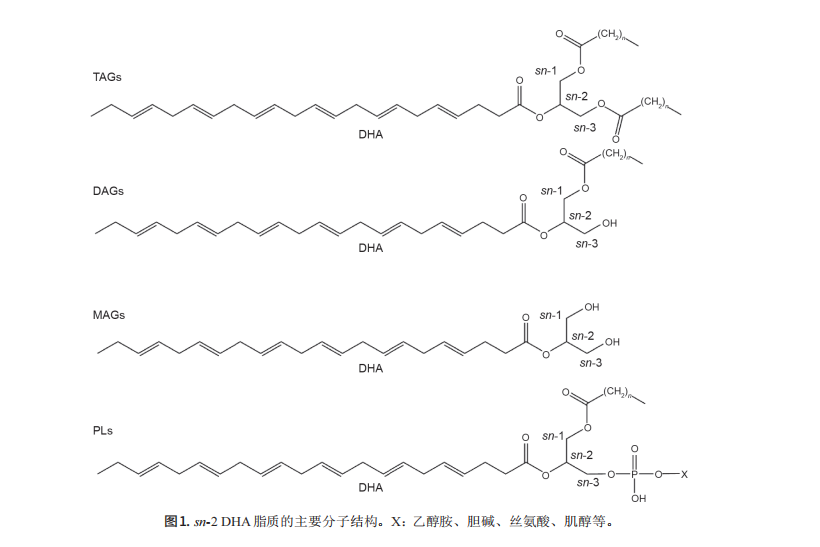
富含 sn-2 DHA 脂质对大脑的益处及其酶法合成综述
金俊 a,b, 金青哲 b, 王兴国 b,*, Casimir C. Akoh a,b,* a Department of Food Science and Technology, The University of Georgia, Athens, GA 30602, USA b International Joint Research Laboratory for Lipid Nutrition and Safety, State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China
摘要
大脑中二十二碳六烯酸(DHA, w-3脂肪酸)的含量与中枢神经系统的正常发育和功能维持高度相关。 甘油酯sn-2位上的DHA可以被肠黏膜更好地吸收,从而实现机体对DHA的高效利用。然而,如今 人们在饮食中摄入较多的饱和脂肪或富含w-6脂肪酸的油脂,而摄入较少的DHA,从而导致了部分 个体在行为和神经生理学方面的缺陷。为了全面了解DHA对大脑的有益功能,本文系统介绍了天 然油脂甘油骨架上DHA的位置分布(sn-2和sn-1,3位)特征,并讨论了DHA补充和通过肠-脑轴传 递信息的潜在功能机制。肠-脑轴包含的多条双向信息通道为DHA、肠道菌群和大脑健康的相互作 用提供了新的研究思路。为了在日常饮食中摄入更多的sn-2 DHA,我们建议通过更为高效和经济 的酯交换制造技术生产富含sn-2 DHA脂质,其中需要解决的关键技术包括强化酶的特异性和优化 纯化工艺。这类饮食可满足对sn-2 w-3脂质有强烈需求的人群,特别是婴儿、儿童、孕妇和哺乳期 妇女。 © 2020 THE AUTHORS. Published by Elsevier LTD on behalf of Chinese Academy of Engineering and Higher Education Press Limited Company This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
1. 引言
二十二碳六烯酸(DHA)是一种22:6 w-3脂肪酸 (FA),它拥有独特的分子结构和多个双键,主要存在 于大脑细胞膜中,对神经和视网膜组织的发育至关重要 [1,2]。胎儿、新生儿和儿童在大脑发育期若缺乏DHA, 可能会造成神经生理学方面的疾病(如认知障碍、焦虑 症等)和视觉功能的降低[3,4]。对于成年人,DHA在 维持认知功能和情绪表现方面也起着重要的作用[5]。 一般,DHA主要来源于富含α-亚麻酸(α-LNA; 18:3 w-3)的饮食和鱼类、藻类等海洋食品。然而,人体内从α-LNA转化为DHA的效率很低,并不能满足日 常所需,尤其是对于孕妇、肝病或枫糖尿病患者[3,6,7]。 另一方面,随着农业改革和食品工业的发展,人们日常 摄入的脂肪已经从海洋油脂或α-LNA类油脂(如亚麻 籽油)转变为w-6类油脂(如大豆油、棕榈液油和玉米 油)与饱和脂肪,从而使w-3脂肪酸的摄入降低,进一 步导致了母乳中DHA的含量的减少[8,9]。因此,现代 食品加入了更多的鱼油、藻油和富含DHA的结构脂质 (structured lipids, SL), 以 便 人 们 可 以 直 接 摄 取 DHA [10]。研究显示,摄入外源DHA的孕妇,其母乳 中的DHA含量会比素食主义者母乳的DHA含量高好几倍 [11]。素食主义者母乳中的DHA主要来源于植物油脂 中w-3 FA在体内的转化。 根 据 油 脂 来 源 不 同,DHA可分布在甘油三酯 (TAG)分子上不同的位点(sn-1,2或3位)。人体摄入 DHA后,sn-1,3位特异性胰脂酶会水解TAG,从而生成 sn-2单甘酯(MAG)和游离脂肪酸(FFA)[12]。sn-2 MAG可在小肠黏膜上被很好地吸收,进而被用于重 新合成TAG或磷脂(PL,脑细胞膜的重要组成部分) [13,14]。相比较而言,从sn-1和sn-3位水解下来的FFA 则没有被针对性地吸收[15]。因此,DHA分布在sn-2位 的TAG比DHA随机分布的TAG更有利于人体的吸收和 利用[16]。类似地,sn-2 DHA MAG相比于DHA甘油二 酯(DAG)和DHA乙酯也更容易被机体吸收[17,18]。 然而,目前关于DHA膳食或保健品的指南基本局限于对 DHA总量的推荐,很少涉及不同DHA位置分布的相关 信息。 基于药理和营养角度,TAG和PL分子中DHA的位 置分布会影响大脑的发育和功能维持,因此阐明常见油 脂中DHA的分布以及富含sn-2 DHA脂质饮食的特点很 有必要。本文同时介绍了富含sn-2 DHA SL的酶法合成 技术以及相关的检测分析方法。
2. 天然油脂和合成脂质中的 sn-2 DHA
DHA主要来源于海洋鱼油和单细胞油脂[19]。sn-2 DHA脂质主要以TAG、DAG、MAG的形式存在于鱼油 和藻油中,也有以PL的形式存在于虾油和蛋黄脂质中 (图1)。 常见油脂中DHA的含量见表1。单细胞藻油(如 Schizochytrium sp.油和Crypthecodinium cohnii油)的 DHA含量最高,为44.89%~48.20%, 其次为金枪鱼油、 沙丁鱼油、凤尾鱼油和鲑鱼油等(9.76%~26.85%)。然 而,在这些鱼油中,sn-2 DHA的含量要高于藻油中的 sn-2 DHA的含量。在鱼油的TAG中,44.79%~72.99% 的DHA分布在sn-2位上,而在藻油TAG中,31.66%~ 42.09%的DHA分布在sn-2位上。这可能与如上所述的 sn-2 DHA脂质消化特性有关。鱼类以藻类为食,通过 消化吸收藻油中的DHA脂质生成富含sn-2 DHA的MAG 或DAG,进而重新合成TAG,从而提高了sn-2 DHA的 占比[15]。 蛋黄和虾油中的脂质一般以PL形式存在(图1), 这与常见的鱼油和藻油中的脂质不同。不同的脂质存在 形式会影响大脑对DHA的吸收。含有虾油的饮食可以

增加大鼠大脑中DHA PL的含量,而PL正是大脑细胞膜 的主要组成部分[32]。 在人乳脂(HMF)中也含有少量DHA,约占总FA 的0.36%~0.70%,其中52.63%~65.15%的DHA分布在 sn-2位上(表1)。然而,DHA的含量从初乳至成熟乳逐 渐减少(0.56%~0.70%→0.36%~0.44%),但在sn-2位上 的相对含量却从52.63%~55.71%增至61.39%~65.15%。 此外,在分娩双胞胎或连续分娩的母亲的母乳中,DHA 的含量逐渐降低[33,34]。临床研究显示,补充了a-LNA 但没有补充DHA的婴儿在出生后的前6个月无法维持其 大脑中正常的DHA浓度[35]。在新生儿体内,a-LNA 转换为DHA的效率同样很低。相比于HMF,许多市售 婴幼儿配方奶粉脂肪(IFF)中的DHA和sn-2 DHA(相 对含量为27.56%~48.17%)水平均较低(表1)。在11款 西班牙产的IFF中,只有一款IFF在sn-2位上含有DHA。 一般而言,为维持神经系统的正常发育,婴儿需从母乳 中日均摄取70~80 mg的DHA [34]。因此,为保护婴儿 免受神经系统发育的缺陷,产妇的饮食中通常需要补充 外源DHA,尤其是sn-2 DHA脂质[4]。
3. sn-2 DHA 对大脑的有益功能
3.1. 吸收 sn-2 DHA 脂质增加大脑中 DHA 的积累 脂质约占脑组织干基重量的60% [34]。尽管DHA是 维持大脑和神经功能正常的关键物质,但其被机体吸收 和利用的程度显著受到其在甘油骨架上的位置分布的影 响。相比于sn-1,2,3位上随机分布的DHA,分布在sn-2 位上的DHA更容易被肠黏膜所吸收[16]。食用富含sn-2 DHA饮食的新生大鼠,其大脑PL [如磷脂酰丝氨酸和磷 脂酰胆碱(PC)]中的DHA含量显著高于对照组食用牛 奶饮食大鼠的大脑PL中的DHA水平(表2)[36]。类似 的研究发现,相比于未酯化的DHA,大鼠大脑可以优 先利用sn-2溶血磷脂酰胆碱DHA(表2)[37]。此外,已 有大规模试验表明,在孕期通过食用较多海洋油脂补充 DHA是安全的[38]。 3.2. DHA 通过肠 - 脑轴增强脑功能 情绪障碍是大脑功能缺陷的症状之一,目前认为该 症状与肠道菌群的改变关系密切[39]。近年来,人们对
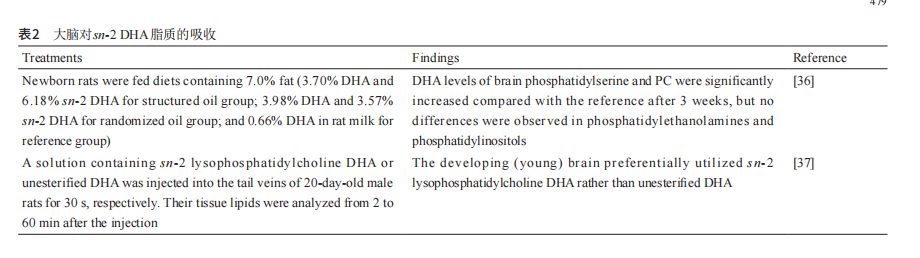
大脑问题(如脑损伤、认知能力下降、精神分裂症、中 风、焦虑症、压力和抑郁症)和肠道菌群之间的相关性 颇感兴趣。人体肠道内生活着1000多种微生物菌群,共 计约100万亿个微生物[40]。不同的菌群会改变大脑的 功能,反之中枢神经系统也可能间接影响肠道微生物的 组成。这一系列综合性的双向信号传导途径被定义为 肠-脑轴或脑-肠-菌群轴,主要涉及迷走神经和脑脊髓 传导通路(图2)[41,42]。 前期研究认为,肠道微生物在开发复杂脑功能障碍 的疗法中起着重要作用。一般而言,含有DHA的饮食 干预会通过改变肠道微生物的组成而对行为和神经生理 障碍产生有益的影响[43,44],见表3。 从表3可知,在大鼠试验中,补充DHA可重新构建 大鼠的肠道菌群并使之正常化,主要表现为有益微生物 (如乳酸杆菌、双歧杆菌和拟杆菌)丰度的增加,同时 变形杆菌(微小未裂杆菌)和蓝细菌等的丰度减少,从 而有助于缓解早期应激、社交孤立或衰老等大脑功能的 相关障碍。此外,García-Ródenas等[49]认为,摄取富 含DHA的饮食,可以使肠道的通透性正常化,进而减 轻心理压力,但该路径未表明需要重新构建肠道菌群。 这种差异表明,肠-脑轴机制包含多种双向信息通道, 其中一些通道尚未被完全探明,因此需要更多的研究来 解释DHA饮食作用于肠道微生物并影响大脑功能的潜 在机制。另外,DHA位置分布差异化的饮食(如富含 sn-2 DHA脂质饮食和DHA随机分布脂质饮食)对肠-脑 轴的影响也有待进一步研究。 4. 酶法合成富含 sn-2 DHA 的油脂 许多婴儿、孕妇和哺乳期妇女仅食用DHA前体物 质或含有有限DHA的食物[11]。目前DHA摄入量减少 主要与西式饮食的流行密切相关[50]。因此,开发低污 染和高效的油脂改性技术势在必行,如以饱和脂肪与
表1中富含DHA的油脂为原料,通过酶法合成富含sn-2 DHA的改性油脂。这些技术主要包括酸解、酯交换、 醇解及其组合反应。 4.1. 酸解反应 许多制备sn-2 DHA SL的方法是将单细胞油脂[如来 自Crypthecodinium cohnii(DHASCO)的DHA单细胞 藻油]和FA(如辛酸)混合,进行一步酸解反应。其中, 所使用的酶主要是sn-1,3位特异性脂肪酶或对DHA具有 高活性的酶。 根据表4所列举的酸解反应,最优条件的料液比为 1:3~1:18(油:FFA)、反应温度为30~55 ℃、载酶量为 4%~15%、时间一般为几十个小时[51–54]。sn-2 DHA的

含量受脂肪酶种类的显著影响[62]。在一些研究中,脂 肪酶,如Pseudomonas sp. KWI-56对甘油的三个结合位 点无特异性,但对DHA和二十二碳五烯酸却具有较高 活性,因此该脂肪酶可以解离sn-2位上的DHA,从而 在一定程度上导致酰基转移[52]。这种副反应在辛酸和 不同脂肪酶存在时尤其容易发生[63]。开发更好的脂肪 酶是尽可能减少酰基转移发生最好的方法。此外,从反 应产物中提纯目标SL一直以来都较为复杂。对于小规 模反应,反应产物中的FFA可以通过碱液中和被去除, TAG则可通过正己烷萃取获得,然后通过进一步蒸发溶 剂就可以获得最终产物SL。 另外一条典型的制备sn-2 DHA SL的技术路径是, 首先水解单细胞油脂或海洋鱼油,以获得DHA,然后 再将DHA酯化成TAG(表4)。在这条技术路径中,首 先在添加有抗氧化剂(如丁基化羟基甲苯)的体系中, 通过氢氧化钾皂化和盐酸酸化海洋油脂获得DHA,随 后DHA与其他油脂酯化成目标SL,具体反应条件是料 液比为1:5~1:18(油:DHA)、载酶量为10%、反应温度 为60~65 ℃、反应时间为24 h [25,31,55]。对于大规模试 验或工业生产,多余的FFA可通过短程蒸馏法除去。 4.2. 酯交换反应 将富含DHA的油脂或DHA乙酯与FA乙酯进行酯交换是制备SL的另一条技术路径(表4)。由于这类反应 涉及反应位置的特异性和DHA的空间位阻,因此对酶 的种类的筛选比较严格[52]。例如,在两步法反应中, 将DHA乙酯和三辛酸甘油三酯以Alcaligenes sp.脂肪酶 作为催化剂进行非选择性反应(50 ℃,90 h)来制取 DHA随机分布的油脂,随后利用Novozym 435脂肪酶作 为催化剂进行sn-1,3位特异性酯交换(40 ℃,40 h),制 得sn-1,3-二辛酸-2-DHA甘油三酯[56]。该反应在充氮体 系中进行,多余的乙酯和三辛酸甘油三酯则通过分子蒸 馏法去除。 4.3. 从 sn-2 DHA MAG 到 sn-2 DHA 甘油三酯 另一条典型的制备富含sn-2 DHA油脂的技术路径 是,首先从海洋油脂中制取sn-2 DHA MAG,随后在 MAG的sn-1,3位上接上FA(图3和表4)。 由于DHA易氧化以及酶法催化过程中的酰基转移 和成本等问题,从油脂中制备sn-2 DHA MAG是该技 术路径的关键环节[64]。传统方法是在乙醇体系中采用 Novozym 435脂肪酶进行反应,这种酶在乙醇中显示出 sn-1,3位特异性[59,60]。最近有研究报道了一种高效的 制备富含sn-2 w-3多不饱和脂肪酸(PUFA)MAG的方 法,这种方法以Candida antarctica脂肪酶A作为催化剂, 是一种较为经济的方法[65]。在一项同以Candida antarctica脂肪酶A为催化剂的研究中,sn-2 DHA含量为 20.88%的鳀鱼油在低温(35 ℃)下反应12 h时可被转 换为sn-2 DHA含量为65.69%的MAG;与之类似,sn-2 DHA含量为3.24%的藻油在低温(35 ℃)下反应12 h时 可被转换为sn-2 DHA含量为22.20%的MAG [66]。这项 研究表明,Candida antarctica脂肪酶A在乙醇体系中表 现出无位置特异性且对w-3 PUFA无偏好,因此该脂肪 酶可较多地裂解非目标FA,从而将w-3 PUFA(如DHA 等)保留在甘油骨架上形成富含DHA的MAG [21,65,66]。 在纯化时,含有DHA的副产物,如FFA和乙酯等, 可通过短程蒸馏法和分子蒸馏法回收,以备后续的重复 利用[67]。这条技术路径的特点是具备较高的灵活性, 并利用sn-2 DHA MAG作为中间体制造不同类型的油 脂,如起酥油、人造黄油、涂抹脂、IFF、烘焙油脂和 糖果油脂等。 5. sn-2 DHA 的分析技术 TAG分子中FA的立体异构性分析主要是通过安装 有火焰离子检测器的气相色谱技术开展。该方法首先利 用sn-1,3位特异性脂肪酶将TAG水解为MAG,然后通过 薄层层析法将sn-2 MAG分离出来,并将其甲酯化后进 行检测器检测[68]。其中,常用的sn-1,3位特异性脂肪 酶是胰脂酶。然而,有研究认为胰脂酶并不能充分水解 TAG分子上所有的FA,尤其是海洋鱼油中的PUFA [57]。 胰脂酶水解的程度取决于FA的种类和双键的位置[69]。 相比较而言,


Candida antarctica脂肪酶B(Novozym 435或Lipozyme 435)则可以较好地水解PUFA [70,71]。 尽管在很多情况下Lipozyme 435是一种非特异性脂肪 酶,但在过量的乙醇体系中,它会表现出sn-1,3位特异 性[70]。有研究分别利用Novozym 435和胰脂酶两种方法测定了鱼油中PUFA的组成,见表5。Novozym 435水 解鱼油中PUFA的效率根据碳链长度与饱和度的不同而 不同。例如,用胰脂酶法测得的二十碳五烯酸(EPA) 含 量(7.5%~10.8%)高于用Novozym 435法测得的 EPA含量(6.8%~9.0%),而DHA的检测结果正好相反 [71]。这说明Novozym 435相比于胰脂酶可以更好地水 解DHA。 总体上,Novozym 435法需要严格的水解条件才能完 全释放TAG的sn-1,3位上的FA,如醇油比、反应时间和温 度等,否则,会因水解反应不充分而导致检测值低于C-13 核磁共振(13C NMR)的检测值或预测值。在一项鱼肝油 试验中,由Novozym 435法得到的sn-2 DHA含量为69.4%, 该值低于由13C NMR法测得的sn-2 DHA含量(72.5%); 而当研究对象为金枪鱼油时,两者的sn-2 DHA含量的检 测结果接近,其中Novozym 435法测得的值为53.1%,13C NMR法测得的值为52.0% [72]。 6. 结论 海洋鱼油和藻油是典型的DHA来源油脂,其中约 一半的DHA FA结合在sn-2位上。相比于分布在sn-1,3位 上的DHA油脂,sn-2 DHA脂质这种独特的结构可促使 DHA更易被肠黏膜所吸收,并被用于体内TAG或PL的 重新合成。因此,sn-2 DHA脂质在大脑功能发育和缓 解焦虑、压力、认知能力下降、精神分裂症和中风等脑 部疾病方面起到积极的作用。研究肠-脑轴是了解DHA 饮食对大脑功能有益影响的最有效策略。该机制认为, 通过DHA饮食的干预可以重新构建或正常化肠道菌群, 从而解决与大脑功能相关的问题。然而,肠-脑轴包含 的诸多双向信息通道尚未被完全研究清楚。今后我们还 需要进一步研究sn-2 DHA脂质补充对肠道微生物和大

脑功能的影响。 人类在两岁以前,大脑中的DHA含量积累迅速。 虽然HMF中DHA的含量在婴儿出生15天后已降至较低 水平,但sn-2 DHA含量却呈增长趋势,这也说明sn-2 DHA在婴幼儿和儿童大脑发育中的重要性。因此,我 们建议在日常饮食中摄入富含sn-2 DHA的SL。这类SL 的制备可首先通过将富含DHA的油脂水解为sn-2 DHA MAG,再在sn-1,3位上结合所需的FA。在未来的研究 中,我们应开发高sn-1,3位活性或对ω-3 PUFA没有偏好 的脂肪酶,从而在温和的反应条件和纯化技术下提高合 成的效率和经济性。
致谢
本文得到了国家留学基金管理委员会资助项目 (201706790068)和江南大学食品科学与技术国家重点 实验室自由探索资助课题(SKLF-ZZA-201705)的支持。 美国乔治亚大学食品科学与技术系也对该工作提供了部 分支持。